全球新藥研發在向中國集結
2019/08/21
日美歐製藥企業開始構建在中國的研究開發體制。法國賽諾菲、日本鹽野義製藥等將利用中國超過13億人口的醫療相關數據,研發疑難病以及在亞洲多發的消化器官疾病等的治療藥物。由於中國政府不斷完善臨床試驗和專利制度,已經出現比歐美還早獲批的新藥上市。曾經被定位於低成本生産基地的中國也將進入製藥廠商等開始集結研發職能的新局面。
據美國調查公司IQVIA統計,中國醫療市場持續擴大,其中藥品市場2018年達到1370億美元,達到2008年的3.4倍。超過日本,繼美國之後排名世界第二。預計到2023年將達到1700億美元。
藥企在中國加強研發職能
圍繞中美貿易戰,對中國的智慧財産權保護的擔憂在擴大,但醫藥品並未成為中美間爭奪的焦點。中國進口的美國醫藥品也被排除在制裁關稅對象之外。由於中國的人工費上漲,作為廉價生産基地的優勢越來越小,在這一背景下,各藥企也著眼加強在當地的研發職能。
 |
賽諾菲在四川省成都市設置了亞洲首個研發基地。在利用大數據分析的同時,將投資6600萬歐元,廣泛研究糖尿病及自身免疫疾病等。
中國人口眾多,便於對一些在日本比較罕見的病症患者和疑難雜症患者集中開展臨床試驗。目前,在歐美盛行一種被稱為藥物重定位(Drug repositioning,或稱「老藥新用」)的研究,具體指尋找已有藥物在適應症狀以外的治療效果的可能性的研究。這類研究也將在中國得以全面開展。
美國輝瑞製藥將仿製藥部門從業務中剝離,5月在上海開設了全球統括總部。其目的是積累和儲備患者數量趨勢和副作用等資料庫。鹽野義則打算構建部分新藥比起日美歐優先在中國研發的體制。該公司正在當地收集結核治療藥臨床試驗開始前的有效性和安全性等數據。
背景是中國政府積極吸引外資企業的政策。2017年,中國加入制定日美歐品質管理標準的國際組織。和日美歐一樣提出了新藥品質管理和保護專利的方針。為了能利用國外的臨床試驗數據,還放寬限制,啟動擴充審查人員優先審查創新性醫藥品的制度。藥品獲批上市的時間因此縮短了1~2年。
2018年12月,美國生物企業和英國阿斯利康(AstraZeneca)共同研發的治療糖尿病併發症「腎性貧血」的治療藥——「羅沙司他」在中國獲批,這是該藥物在全球首次獲得批准。羅沙司他目前正在歐美進行臨床試驗。在日本,製藥企業安斯泰來製藥取得聯合研發權,目前仍處於申請生産銷售許可的階段。
中國存在許多未被利用的疾病數據。在中國研發胃癌等亞洲常見的消化器官疾病,還可以輕鬆地出口亞洲。在可以廣泛應用的新藥的研發變得越來越困難的背景下,中國正成為重要的研發基地,並將決定著企業的競爭力。
中國企業在白色家電、智慧手機等領域的市佔率已躍居全球前列,但在醫藥領域尚未顯示出存在感。中國政府提出的産業發展政策「中國製造2025」中提到了生物製藥。目的是積極吸引外資企業投資,提高中國國內的新藥研發實力。
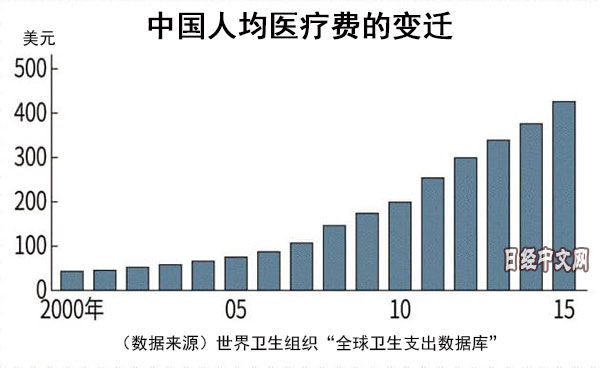
中國每人平均醫療費15年裏增至近10倍
中國擁有超過13億的人口,近年來隨著經濟增長,健康壽命也在延長。據世界衛生組織(WHO)統計,從平均壽命來看,截至2015年,男性達到74.6歲,女性達到77.6歲,以高收入者階層和中産階層為中心,健康意識不斷提高。國民每人平均醫療費2015年達到426美元,增至2000年的近10倍。
 |
市場擴大的原因之一是醫療需求的變化。1990年,感染性疾病佔中國民眾死亡原因的17%,但隨著治療藥物的普及,2015年減少至9.8%。另一方面,高血壓和糖尿病等導致的腦血管疾病和癌症等疾患呈現增加,在疾患構成方面,變得和已開發國家相同。與通過抗菌藥治療的感染性疾病不同,需要手術和高額醫藥費的治療正在推動整體醫療費的上升。
中國市場上流通的藥品的8成被認為是仿製藥,外資企業銷售的藥品也是專利在歐美等國到期的藥品。中國政府針對在國內流通的仿製藥,要求提交再次確認有效性的品質數據,以排除劣質藥品。為了能和已開發國家同步用上新藥,中國還在推進放寬審批限制,致力於提高醫療水準。
版權聲明:日本經濟新聞社版權所有,未經授權不得轉載或部分複製,違者必究。
