新冠抗體治療藥在美國進入實用階段
2020/11/24
在新冠治療方面被視為首選藥物的「抗體藥物」已進入實用化階段。美國企業正在開發的新藥相繼在美國國內附加條件獲准使用。現在的新冠治療藥大多是轉用其他疾病的治療藥,但抗體藥物則是新冠專用藥。與預計近期在局部啟動接種的疫苗一起,抗體藥物有可能開闢克服新冠病毒的道路。
抗體是與冠狀病毒結合後使病毒失去活力的蛋白質,被用於抗體藥物。模倣已康復者的血液中的抗體等,由人工製造。據稱抗體藥物主要面向輕症至中等程度的患者,通過早期用藥,有望減少重症患者。
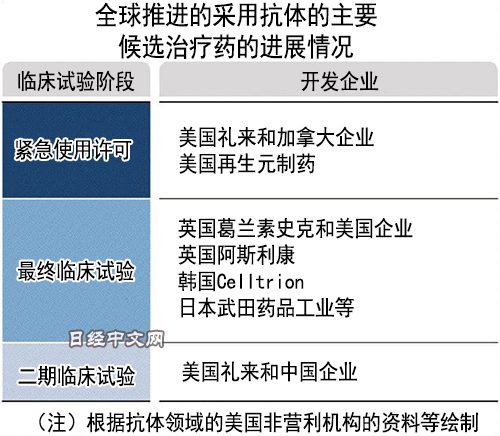 |
美國食品藥品監督管理局(FDA)11月21日批准了美國再生元製藥(Regeneron Pharmaceuticals)開發的抗體藥物的緊急使用。這是美國總統川普感染新冠病毒時使用的藥物,雖然仍未獲得正式批准,但允許在沒有其他有效治療方法等情況下使用。
目前臨床試驗的結果顯示,對並未住院的輕症到中等程度患者用藥後,其體內的病毒量減少。FDA在聲明中指出,「顯示出(患者用藥後)住院和急救治療的減少」。
 |
| 美國藥企禮來的標誌(REUTERS) |
FDA在11月上旬向美國藥企禮來(Eli Lilly)的抗體藥物「Bamlanivimab」發出緊急使用許可。在該公司的第2階段臨床試驗中,在用藥的患者中,需要住院和進入重症監護室(ICU)的患者僅為1.6%,遏制了重症化。
日本島根大學的浦野健教授表示,「如果能在較早階段抑制體內病毒繁殖,很有可能減輕重症化風險」,指出了抗體藥物的效果。
現在的新冠治療藥均為面向其他疾病開發出來的藥物。作為代表性例子「瑞德西韋(Remdesivir)」原本面向伊波拉出血熱而開發,抑制免疫失控的「地塞米松(Dexamethasone)」則面向風濕病等。
不過,這些藥物的效果分化和使用困難等問題被指出。針對瑞德西韋,世界衛生組織(WHO)表示「不建議對住院患者使用」。而在日本,很多醫生承認具有一定效果,但該藥的評價在各國存在分歧。
抗體藥物的開發將迅速推進。包括擱置的藥品在內,全球現在有近20種候選藥推進臨床試驗,數種藥已進入最終階段。另一方面,關於抗體藥物臨床試驗的數據和評估仍未全部齊備,副作用也是未知數。獲得緊急使用許可的2種也仍在推進最終臨床試驗,以進行驗證。
另一個課題是成本。一般來説,抗體藥物容易昂貴。雖然抗體藥物在癌症治療等方面得到使用,但按日本的藥價計算,1次治療需要數百萬日元的情況很多。
即使作為新冠治療藥的效果得到認可,全球大量患者也可能無法承擔抗體藥物的費用。美國政府與禮來簽署了3.75億美元的合同,在處於緊急使用許可的期間,預計在無需患者自己負擔費用的情況下提供藥物。對於抗體藥物的普及,預計有關用藥對象患者等的討論也必不可少。
版權聲明:日本經濟新聞社版權所有,未經授權不得轉載或部分複製,違者必究。
