阿斯利康暫停臨床試驗,疫苗研發需警惕「拙速」
2020/09/10
對於正在急速研發的新型冠狀病毒疫苗,安全性的擔憂浮出水面。9月8日,英國阿斯利康公司稱,已暫停最後階段的臨床試驗。很多專家都對追求快速實用化的政治行動敲響了警鐘,主要研發企業也採取了慎重態度。
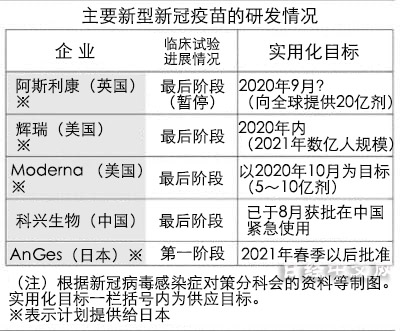 |
阿斯利康的疫苗被看作是極有希望的候選疫苗之一,美國川普政府對開發提供援助,並對其早日獲批表示期待。該企業還在日本、英國、巴西、南非等國家進行了臨床試驗。由於懷疑其中一名參與者出現嚴重的副作用,全球已停止用藥。預計查明原因需要花費一定時間,試驗重啟時間尚不確定。
日本政府已與阿斯利康達成1.2億劑疫苗的供應協議。計劃從2021年初開始提供疫苗,當年3月之前首先確保3000萬劑。日本官房長官菅義偉在9日的記者會上表示,「經厚生勞動省確認,(阿斯利康)解釋稱包括日本在內將暫停用藥」。厚生勞動省相關負責人稱「目前無法預測未來的影響」。
這種疫苗是被稱為「病毒載體」(Virus Vector)的新類型,美國強生(Johnson &Johnson)和中國康希諾生物等企業都在研發這種疫苗,8月俄羅斯批准的疫苗也是同樣的類型。這種疫苗使用DNA和RNA等部分病毒的遺傳資訊等,大多採用此前未被認可的新技術。
因為疫苗是給健康人用的,因此需要嚴格調查安全性和有效性。臨床試驗有三期,第一期要花半年到1年時間,第二期要花1~2年時間,第三期需要1~3年時間。如果是新技術,有時需要將近10年時間。根據各國政府的意向,大都準備在1年以內批准新冠疫苗。
俄羅斯的疫苗省略了第三期臨床試驗。有專家認為一二期的數據處理等也存在問題,安全性確認不夠充分。領先的阿斯利康及美國Moderna等正在依次開展臨床試驗,但各階段的時間只有1~3個月。
主要研發企業近來都保持慎重態度。9月8日,美國輝瑞、法國賽諾菲及阿斯利康等9家企業發表了聯合聲明,表示最優先保證安全性,只有通過最終的臨床試驗確認安全和效果之後才申請批准。對政府方面希望儘早批准的舉動形成牽制。
日本國際醫療福祉大學教授和田耕治表示,「企業受到各種各樣的壓力,但不能因此就不充分地確認安全性」,在儘快獲批後「如果出現安全性問題,也應該停止接種」。
新冠疫苗在有效性方面的審批標準很低。美國食品和藥物管理局(FDA)等提出50%以上的有效性,低於普通疫苗的80%以上的標準。
東京大學教授石井健指出,「如果安全性和效果存疑,就算是很好的疫苗,拒絕接種的人也有可能增加」。如果「反疫苗」運動擴大到世界,新冠疫情的平息可能會大大延遲。
版權聲明:日本經濟新聞社版權所有,未經授權不得轉載或部分複製,違者必究。