全球主要藥企新冠疫苗開發停滯
2020/10/19
新冠疫苗的開發由於安全方面的擔憂而停滯不前。在9月底以後,美國製藥企業輝瑞(Pfizer)和Moderna相繼宣佈推遲研發日程。美國總統川普要求10月推出疫苗,通過政治手段敦促企業迅速推進開發。另一方面,製藥企業則認為必須徹底驗證副作用,正在加強慎重態度。
「將重視公共的信賴。可能推遲至11月第3周以後再申請緊急使用許可」。輝瑞10月16日發佈聲明,對美國政府提出的在10月內實現實用化目標提出了懷疑。川普一直要求在11月3日美國總統選舉之前推出疫苗,但能否實現籠罩陰影。
 |
| 俄羅斯開發的新冠疫苗 |
各家製藥企業自3月起正式啟動疫苗開發,目前有10家企業處於最終臨床試驗階段,但最近開發遲緩顯得突出。
美國強生(J&J)最近宣佈,暫停以6萬人規模推進的新冠疫苗最終臨床試驗,重啟時期未定。美國Moderna針對定在10月的臨床試驗結束時間表示,「或將推遲至11月或12月前後」。英國阿斯利康(AstraZeneca)表示出現了疑似副作用的症狀,9月宣佈暫停臨床試驗。
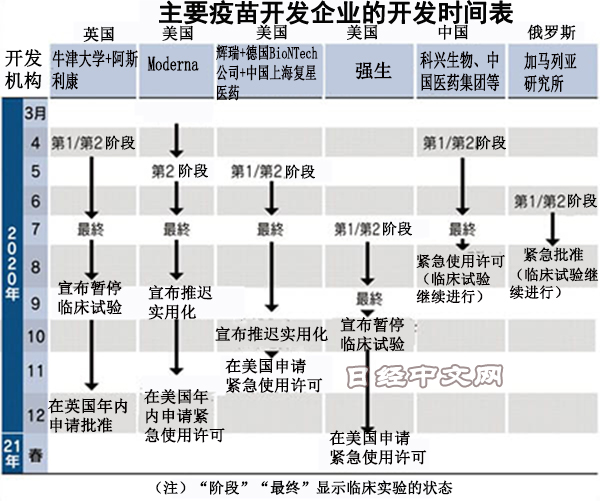 |
在通常的臨床試驗中,只要沒有相繼出現死亡或嚴重副作用等臨床試驗難以推進的情況,就不會公佈中途經過。像此次這樣,在仍未弄清因果關係的階段發佈暫停臨床試驗的聲明實屬罕見。各家藥企此前表示,「發現明顯免疫效果」等,對有效性顯示出自信,但目前態度突然改變。
主要原因是迅速開發導致難以驗證效用。疫苗用於健康人,尤其重視安全性。開發疫苗最低需要3~5年,使用新技術時需要近10年。還要在接種後的1、2年進行長期觀察,持續觀察産生哪些副作用及其頻率、預防效果達到多長時間等。要開發在醫療一線使用的醫藥品,這些工作不可缺少。日本國內製藥企業表示,「證實數據是製藥企業的生命線」。
在此次的新冠全球大流行中,臨床試驗時間僅為2~3個月,難以給數據分析留出充裕時間。各國政府對疫苗早期實用化持積極態度。以美國政府為例,提出「曲率急速行動(Operation Warp Speed)」,積極為2020年內疫苗實用化提供支援。中俄也作為緊急措施已開始使用疫苗。
各國政府承諾在新冠疫苗出現副作用時由政府擔責,給予企業免責,但企業擔憂由於銷售安全性存在隱憂的醫藥品,導致可靠性和品牌形象受損。這是因為信用風險有可能波及正在銷售的其他醫藥品。
美國輝瑞、法國賽諾菲、英國阿斯利康等9家製藥企業9月發佈聲明,表示「最重視安全性,僅在通過最終臨床試驗確認安全和效果後才申請批准」。對於政府希望儘早批准疫苗的意圖進行了牽制。
與此同時,監管機構最近也開始變得慎重。美國食品藥品監督管理局(FDA)10月後收緊了疫苗的批准標準。要求在最終臨床試驗結束後,獲得2個月以上的安全性追蹤數據等,還要求分析副作用的風險和有效性。
新冠疫苗還能供給其他國家,容易成為外交牌。如果今後發生第2波、第3波疫情,疫苗的開發需求將進一步提高。輕視安全性帶來的損害也難以估量。與新冠的戰鬥是政府和企業面臨的沉重課題。
日本經濟新聞(中文版:日經中文網)尖端醫療編輯 高田倫志
版權聲明:日本經濟新聞社版權所有,未經授權不得轉載或部分複製,違者必究。
