衛材的阿茲海默新藥將在中日歐申請批准
2023/01/09
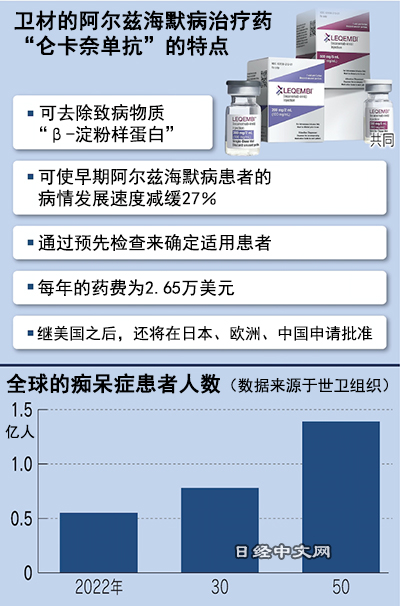
日本衛材(Eisai)1月7日發佈消息稱,該公司與美國渤健(Biogen)共同開發的阿茲海默症治療藥物獲得了美國相關部門的快速批准,允許其作為藥品使用。全球人口老齡化問題加劇,衛材首席執行官(CEO)內藤晴夫預測稱,「到2030年,新藥的適用患者將達到約250萬人」。衛材打算繼美國之後,在日本、歐洲、中國進行申請,力爭在2023年度內獲得批准。
美國食品藥品監督管理局(FDA)6日快速批准了衛材和渤健開發的新藥「侖卡奈單抗(Lecanemab)」。這款新藥以早期阿茲海默症患者為對象,從腦部清除被認為是致病物質之一的蛋白質「β-澱粉樣蛋白」的效果受到好評。
 |
內藤晴夫在接受日本經濟新聞(中文版:日經中文網)的採訪時表示,「未來3年,美國將有10萬人使用這種藥,能獲得相當大的份額」。他還預測稱,「包括中國和印度等國家在內,2030年全球將有250萬名患者使用該藥」,顯示出今後積極擴大銷售的態度。
全球的癡呆症患者被認為超過5000萬人,預計到2030年將增加至約8000萬人。阿茲海默症在癡呆症中的佔比超過6成,隨著病情的發展,患者會出現腦萎縮,喪失記憶和思考能力,最終難以正常生活。
這種病至今仍缺少治療症狀的藥物。2021年由衛材和渤健共同開發的「阿杜那單抗(aducanumab)」為首款可長期抑制認知功能下降的藥物,但由於臨床試驗數據不夠充分,而且價格昂貴,最終未能普及。
侖卡奈單抗在最後階段的臨床試驗中證明了可使阿茲海默症患者的症狀惡化速度減緩27%的效果。每年的藥費為2.65萬美元,不到阿杜那單抗最初價格的一半。
新藥普及有利於降低醫療和護理費用等,內藤表示「僅在美國就有相當於數百億美元的社會價值」。
版權聲明:日本經濟新聞社版權所有,未經授權不得轉載或部分複製,違者必究。
報道評論
HotNews
金融市場
| 日經225指數 | 56941.97 | -697.87 | 02/13 | close |
| 日經亞洲300i | 2681.80 | -15.65 | 02/13 | close |
| 美元/日元 | 152.73 | -0.27 | 02/14 | 05:50 |
| 美元/人民元 | 6.9077 | 0.0080 | 02/13 | 17:40 |
| 道瓊斯指數 | 49500.93 | 48.95 | 02/13 | close |
| 富時100 | 10446.350 | 43.910 | 02/13 | close |
| 上海綜合 | 4082.0726 | -51.9451 | 02/13 | close |
| 恒生指數 | 26567.12 | -465.42 | 02/13 | close |
| 紐約黃金 | 5022.0 | 98.3 | 02/13 | close |







